На поверхности изделий, получаемых путем горячей прокатки, присутствует железная окалина. Ее возникновение обусловлено особенностями данного производственного процесса. Окалина значительно сокращает коррозионную стойкость материала и усложняет последующую обработку, поэтому необходимо полное ее удаление.

Процесс образования
Рассматриваемое покрытие представлено продуктом окисления металла. Его формирование связано с высокими температурами и происходит при обработке металла температурой либо давлением. Прокат в любом случае покрыт окисным слоем. Он образуется на открытом воздухе в сухих условиях в виде пленок. Изначально они невидимы даже под микроскопом. Под термическим воздействием толщина окисного слоя возрастает до видимых размеров. Железной окалиной называют толстое покрытие, формирующееся при термическом воздействии в условиях открытого воздуха.
Состав формирующих его окисных соединений и структура определяется многими факторами: маркой стали, температурой, условиями среды, режимом термообработки, наличием и количеством окислителей.
Они представлены гематитом, магнетитом, вюститом. Первые два оксида железа характеризуются большой плотностью и соединены промежуточной структурой. Вюстит наоборот представлен пористым соединением. От названных выше оксидов он отличается большей диффузинной проницаемостью. Вюстит имеет с ними непрочную связь.

Структура железной оксидной пленки определяется окружающими условиями и температурой. Так, в кислородосодержащей среде при нагреве более 570 °C и быстром охлаждении формируется трехслойное покрытие. Внешний слой представлен гематитом, следующий – магнетитом и внутренний – вюститом. Как было отмечено, первые два имеют кристаллическую структуру и прочно взаимосвязаны. Внутренний слой пористой структуры непрочно контактирует с ними. Это обуславливает малое электросопротивление железной оксидной пленки и легкое ее отслаивание.
Для образования трехслойной окалины на металле необходимо соблюдение трех названных условий: высокой концентрации кислорода, температуры в 570 °C, быстрого ее снижения. Иначе формируется двух- или однослойная железная окалина.
Так, при меньшем нагреве слой вюстита получается тонким. В случае формирования железной окалины при высокой концентрации пара либо окислов углерода при малом количестве кислорода и температурах более 1000 °C гематит восстанавливается, вследствие чего отсутствует в составе. Таким образом, соотношение слоев напрямую определяется температурой. Так, при 700 °C толщина вюстита составляет 100 мкм, в то время как для магнетита и гематита – 10 и 1 мкм соответственно. Другими словами, состав железной окалины в значительной степени зависит от температуры. Так, при 700-900 °C она представлена почти на 90% вюститом, примерно на 10% магнетитом и менее чем на 1% гематитом. При большем нагреве и избытке кислорода происходит замещение вюстита гематитом.
В любом случае формирование слоев железной окалины происходит последовательно в соответствии с их расположением. При охлаждении вюстит утрачивает устойчивость и распадается до железа и гематита. Ввиду этого пленка обретает гематит-магнетитовый состав. При восстановлении гематит и магнетит переходят в железо и воду. Следовательно, в результате получается прокатная окалина, состоящая из железа.

Выше приведены основные закономерности и факторы возникновения железной окалины. В промышленных условиях процесс ее образования весьма сложен и может происходить неоднократно.
Методы удаления
Удаление окалины осуществляют тремя способами. Механический метод включает следующие варианты: пропускание материала через ряд роликов, обработку дробью и прочими абразивными материалами. Первая технология основана на деформации металла скручиванием, изгибом, растяжением. Такой способ позволяет убрать большую часть окалины. Его считают черновой обработкой, и после очищают материал дополнительно. Во втором случае осуществляют механическое воздействие на железную окалину металлической дробью, песком и прочими абразивными материалами. Наконец, существуют механизированные технологии, связанные с применением микрорезцовых инструментов, проволочных щеток, наждачных лент и т. д.
Химические методы подразумевают обработку деталей в кислотах, солях, щелочах, называемую травлением. При этом большое значение имеет растворимость составляющих железную окалину соединений в кислотах. Так, вюстит легко подвержен ему, в отличие от магнетита. Гематит считают нерастворимым. Травление дифференцируют на химическое и электрохимическое. Далее рассмотрены некоторые варианты.
Травление серной кислотой связано с образованием водорода и проникновением его в металл, что ведет к водородной хрупкости, снижающей механические параметры и затрудняющей последующую обработку материала. Поэтому с целью сокращения наводораживания приходится долго выдерживать металл по завершении травления либо нагревать при сушке. К тому же во избежание разрушения металла кислотой после растворения железной окалины используют ингибиторы. Нужно отметить, что в нагретом растворе сталь разрушается быстрее.
Травление соляной кислотой идет по тем же закономерностям. Однако, в отличие от серной, для этого не требуется нагрев. Напротив, при температуре более 40°C выделяются хлороводородные соединения. В процессе травления формируются хлористые соли железа. В целом обработка соляной кислотой, в сравнении с серной, обеспечивает лучшую очистку при меньшем наводораживании стали.


Электрохимический способ существенно повышает скорость очистки металла от окалины и сокращает водородную хрупкость, а также расход раствора. Его дифференцируют на анодный, катодный и смешанный варианты.
Выбор способа очистки определяется многими факторами, среди которых состав изделия, целевые параметры, последующая обработка и т. д.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Окалина, образующаяся при обычном нагреве, горячем деформировании и охлаждении стального изделия, а также при его термической обработке, представляет собой комплекс химических соединений железа и других элементов с кислородом (оксидов, гидратов, силикатов, сульфидов, карбидов и др.).
Основными составляющими структуры окалины являются оксиды железа; доля других элементов, а также их более сложных соединений незначительна и зависит главным образом от марки стали и способа ее раскисления.
В начальной стадии окисления металла протекает химическая реакция его с окисляющим газом, при этом на поверхности металла образуется тончайший слой оксидов. Дальнейшее окисление происходит путем реакционной диффузии ионов кислорода и металла навстречу друг другу сквозь непрерывно утолщающийся слой окалины.
В окалине присутствуют также сложные соединения других элементов, которые попадают в сталь при раскислении (например, алюминия, кремния, марганца) или при легировании (например, хрома, марганца, никеля, вольфрама и др.). Эти соединения образуют промежуточный слой, располагающийся между основным металлом и окалиной.
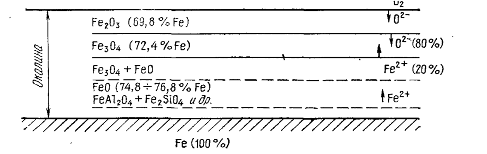
Рис. Схема образования окалины
Окалина углеродистой стали, образующаяся при температурах выше 600°С, состоит из оксидов железа FeO (вюстит), Fe34 (магнетит) и Fe23 (гематит). Оксиды располагаются слоями в соответствии с уменьшением содержания кислорода в направлении от наружного слоя к внутреннему (рис. 21).
Вюстит (FeO) —наиболее мягкая и рыхлая составная часть окалины с небольшой абразивностью. Он хорошо растворяется в кислотах и полностью может быть удален механическим путем. Поэтому окалина в виде вюстита предпочтительнее других оксидов.
Магнетит (FезО4) обладает значительной абразивностью и почти не растворим в кислотах.
Гематит (Fe23) обладает высокой абразивностью и плохо растворяется в кислотах.
При твердости металла по Виккерсу в 140 ед. твердость FeO составляет 270—350, Fe34 420—500, Fe23 1030 ед.
Следует иметь в виду разницу между окалиной и ржавчиной: первая является комплексом химических соединений железа и других элементов в стали, образующихся при высоких температурах; вторая представляет собой продукт окисления металла при нормальной температуре в условиях действия на него влаги и загрязненного воздуха.
В составе этого продукта в основном находятся Fe(OH) коричневого цвета (гидротизированный магнетит F34 •Н20), хлориды, сульфаты и другие соединения. Указанные соединения не образуют на поверхности изделия плотной пленки. При слишком долгом хранении металла ржавчина стареет и ее трудно удалить как кислотами, так и механическими способами. Поэтому следует избегать чрезмерно долгого хранения катанки в условиях сырой и за грязненной атмосферы. Количество и структура окалины при прокатке катанки зависят от температуры, скорости и способа ее охлаждения.
Выше 950°С и при избытке кислорода медленно охлажденная катанка имеет очень пористую окалину в количестве до 30кг/т, почти целиком состоящую из магнетита и гематита. В случае ускоренного одностадийного охлаждения катанки окалина состоит в основном из FeO в количестве 12-16 кг/т. Регулируемое ускоренное двух стадийное охлаждение снижает количество окалины до 2-4 кг/т. Для уменьшения количества окалины японские фирмы предлагают после водяного охлаждения помещать катанку в камеру с без окислительной атмосферой для проведения второй ступени охлаждения. Катанка с окалиной из вюстита в количестве до 1 кг/’т при нанесении подсмазочного слоя непосредственно на окалину может быть протянута безпредварительного ее удаления.
В литературе количество окалины на металле указывают по-разному: килограмм на тонну катанки (кг/т), толщина слоя окалины в миллиметрах (мм), количество окалину в процентах к массе окисленного металла (%), в граммах на квадратный метр поверхности катанки (г/м 2 ).
Для определения количества окалины в разных единицах существуют формулы, в которых плотность окалине принята равной 5,5 г/см 3 :
где а – толщина слоя окалины, мм; d – диаметр катанки, мм; Р -отношение массы окалины к массе катанки, %
Для пересчета количеств окалины в разных единицах измерения можно пользоваться следующими формулами:
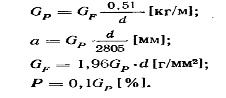
2. Способы удаления окалины
Окалина может быть удалена с поверхности металла механическим, химическим, электрохимическим и комбинированным способами.
Механический способ удаления окалины заключается в пропускании окисленной проволоки и катанки с окалиной через ряд роликов с резкими перегибами, а также в обработке их дробью или абразивными материалами; двумя последними способами очищается подкат.
Механическое удаление окалины основано на деформации изгибом, скручиванием или растяжением; прямом воздействии на поверхность изделия специальных реагентов: металлической дроби, песка и других абразивных материалов (дробеметная, пескоструйная обработка); удалении поверхностного слоя металла при помощи вращающегося микро резцового инструмента – иглофрез, стальных проволочных щеток и т. д.
Удаление окалины деформацией является черновой обработкой. В этом случае окалиноломателями удаляют большую часть окалины. Как правило, окончательно поверхности металла обрабатывают щетками из стальной проволоки, наждачными лентами, абразивными материалами во вращающихся барабанах и т. д.
Одним из методов удаления окалины являтся дробеметная или пескоструйная обработка, при которой стальную или чугунную дробь или песок (увлажненный) направляют на поверхность очищаемого изделия центробежной силой быстровращающихся колес, снабжаемых специальными лопаточками. По данным НИИметиза, при скорости движения катанки из низкоуглеродистой стали 3,5-11,0 м/мин ее поверхность полностью очищается от окалины за 0,8 с. Часть окалины осыпается с катанки или проволоки при прохождении их через направляющие ролики, установленные перед входом в камеру.
Механическим способом удаляют окалину с мягкой проволоки. После такой обработки поверхности несколько повышается расход волок и требуется специальная смазка.
Процесс удаления окалины и оксидов с поверхности металлов путем обработки изделий в растворах кислот и кислых солей или щелочей называют травлением. Травление проволоки перед волочением и нанесением металлов покрытий проводят химическим или электрохимическим способом. Выбор способа травления зависит от природы металла, характера и толщины покрывающих его оксидов, атакже от его дальнейшей переработки. Другие способы удаления окалины (например, механический, водородисто натриевый процесс) при подготовке поверхности проволоки к| металлопокрытию не нашли пока применения. Для травления проволоки используют серную, соляную, иногда фосфорную, азотную, плавиковую кислоты, а также смеси кислот.
Химическое травление в серной кислоте Серная кислота – химическое вещество., состав которого отвечает формуле H2SO4, называется моногидратом. Это вещество можно считать соединением одной молекулы серного ангидрида SO3 с одной молекулой воды Н20. Поэтому в технике серной кислотой называют любые смеси серного ангидрида с водой. Если такой смеси на одну молекулу SO3 приходится больше одной молекулы Н20, то они являются водными растворами серной кислоты; если же на одну молекулу SO3 приходится меньше одной молекулы Н20, то смеси являются растворами серного ангидрида в серной кислоте, такие растворы называют олеумами.
В зависимости от способа производства техническая серная кислота, согласно ГОСТ 2184—59, распределяется на три вида: контактную, башенную и регенерированную. В практике сохранилось также старое название серной кис лоты, которую раньше получали сухой перегонкой железного купороса: купоросное масло. Контактная кислота раз делятся на техническую, техническую улучшенную и олеум. Техническая кислота содержит 92,5, техническая улучшенная 92,5—94 %, башенная 75 %, регенерированная 91 % моногидрата (H2SO4).
Необходимо постоянно наблюдать за концентрацией серной кислоты, хранящейся в емкостях, особенно в зимний период.
При травлении в серной кислоте окисленной стали протекают следующие основные химические реакции.-
Вследствие наличия пор и трещин в окалине действие кислоты на окалину и металл начинается почти одновременно. Растворимость FeO значительно больше, чем Fe34 и Fe203. Два последних оксида отрываются главным образом механически водородом, выделяющимся при взаимодействии кислоты со сталью. Fe34 и Fe203 падают на дно травильной емкости, где постепенно восстанавливаются водородом и растворяются в травильном растворе.
На процесс травления стали в серной кислоте влияют концентрация раствора и температура. Минимальная длительность травления наблюдается при концентрации кислоты 250—300 г/л. Более высокие концентрации раствора ведут к замедлению процесса. На практике для травления проволоки из высокоуглеродистой стали применяют обычно растворы, содержащие 50-100 г/л H2S04, и вырабатывают их до содержания 25-30 г/л H2S04. Для поточного травления исходная концентрация травильного раствора составляет 150-200 г/л H2S04. Для проволоки из низкоуглеродистой стали и проволоки промежуточных размеров из среднеуглеродистой стали исходный раствор содержит 75-200 г/л H2S04 и выработанный – до 10-15 г/л H2S04. При травлении катанки выработку раствора серной кислоты доводят до остаточного содержания моногидрата 5 г/л.
Потерю скорости травления при понижении концентрации кислоты компенсируют повышением температуры раствора, которая оказывает решающее влияние на его активность. При высоких исходных концентрациях температура раствора составляет 250-30°С, с понижением концентрации температуру повышают до 70-90 °С.
Перемешивание травильного раствора (барботаж) воздухом или другим способом, а также покачивание обрабатываемого металла существенно ускоряют процесс и улучшают качество травления.
В результате реакций, происходящих при травлении, появляется сернокислая соль железа (сульфат железа FeS04), называемая железным купоросом. Количество сульфата железа возрастает с увеличением длительности использования травильного раствора. Скорость травления (активность раствора) с увеличением концентрации сульфата до 80 г/л резко падает, а при дальнейшем увеличении его концентрации почти не изменяется. Особенно заметно снижается активность раствора при невысоких концентрациях серной кислоты. Накопившийся железный купорос выкристаллизовывается на поверхности проволоки и портит ее. Поэтому обработку проволоки ответственного назначения из высоко- и средне углеродистой стали проводят в травильных растворах, содержащих не более 70- 80 г/л FeS04. При травлении проволоки из низкоуглеродистой стали содержание FeSО4 не должно превышать 100-150 г/л. Травильный раствор с высоким содержанием железного купороса может быть регенерирован охлаждением до низких температур и применением вакуума.
При взаимодействии кислоты с металлом активно выделяется водород. Находясь в атомарном состоянии, водород проникает в металл и вызывает водородную (травильную) хрупкость. Такое явление нежелательно, так как приводит к снижению механических свойств металла и затрудняет его дальнейшую переработку. Уменьшают наводороживание нагревом (обычно при сушке) или продолжительным выдерживанием металла после травления.
В горячем растворе серной кислоты сталь растворяется с большой скоростью. Это растворение начинается с момента погружения проволоки в раствор, а по мере освобождения металла от окалины в контакт с раствором входят все большие и большие участки металла. Чтобы сократить потери металла и его порчу в результате продолжительного взаимодействия с кислотой (перетрав), в кислотный раствор вводят ингибиторы (замедлители коррозии) – вещества, способные задержать разрушение металла.
В сталепроволочном производстве используют органические ингибиторы травления (присадки) И-2В, С-5У, ПКУ, ХОСП-10.
Присадку (для черных металлов) вводят в количестве 1,0-1,5 г/л травильного раствора. В качестве пенообразователя используют добавку КБЖ. Из неорганических присадок распространена поваренная соль NaCL Ингибиторы: снижают потери металла на растворение, уменьшают наводороживание, устраняют перетрав, сокращают выделение вредных испарений.
Продолжительность травлений в серной кислоте составляет от нескольких минут до 1 ч и более, она зависит от условий травления, характера окалины.
Химическое травление в соляной кислоте
Раствор хлористого водорода НС1 в воде называется хлоро-водородной или соляной кислотой. Концентрированная соляная кислота (плотность 1,19 г/см 3 ) содержит около 35 % НС1. Эта кислота относится к наиболее сильным кислотам,; она энергично растворяет многие металлы и взаимодействует с оксидами.
При травлении в соляной кислоте протекают следующие химические реакции:
2FeCl3 + H2 → 2FeCl2 + 2HCI.
В соляной кислоте поверхность металла очищается от оксидов в результате их растворения. С увеличением концентрации и температуры кислоты скорость растворения: непрерывно и быстро возрастает. В отличие от серной соляная кислота оказывает активное воздействие на оксиды и металл при травлении их в ней уже при комнатной температуре. Нагрев раствора соляной кислоты выше 40 0 С приводит к интенсивному выделению вредных хлороводородных соединений.Травление стальной проволоки обычно проводят в растворе, содержащем 100-230 г/’л НС1, иногда для травления мотков стальной проволоки используют раствор с 40- 100 г/л НС1.
Хлористые соли (FeCl2 и FeCl3), образующиеся при травлении в соляной кислоте, хорошо растворяются в травильном растворе и воде. Увеличение их концентрации не замедляет травления, а даже несколько ускоряет его благодаря образованию FеС1з. Однако FeCl3 уменьшает активность травильного раствора. Поэтому на практике при замене отработанного травильного раствора в свежеприготовленный раствор для активации добавляют небольшие количества отработанного отфильтрованного раствора. Раствор, в котором накапливается более 120-160 г/л хлористых солей, необходимо частично или полностью заменять.
Травление в соляной кислоте обеспечивает более чистую поверхность проволоки, чем травление в серной кислоте. Соляная кислота в меньшей степени наводороживает металл, чем серная.
Химическое травление в других кислотах
В подготовительных перед металлопокрытиями процессах иногда применяют фосфорную, азотную и плавиковую кислоты.
Химический процесс травления металла в азотной кислоте:
Травление в ортофосфорной кислоте Н3Р04 позволяет получить высокую коррозионную стойкость поверхности проволоки, но из-за высокой стоимости кислоты (в 10 раз дороже серной) применяется сравнительно редко.
Фосфорная кислота Н3РО4 (плотность в исходном состоянии 1,7 г/см 3 , концентрация 85%) непосредственно для стравливания окалины используется редко. Ее целесообразно применять для чистого травления после предварительного травления в серной или соляной кислотах. В процессе чистого травления, которое применяют перед декапированием, поверхность металла становится боле чистой и на ней образуются фосфаты железа, уменьшающие коррозию проволоки при хранении и улучшающие качество наносимого металлопокрытия, например цинкового. Для травления окалины концентрация Н3РО4 составляет 150-350 г/л, температура раствора 80 °С; для чистового травления концентрация Н3РО4 составляет 20-40 г/л, а температура 40-50 °С,
Азотная кислота HN03 (плотность в исходном состоянии 1,4 г/см 3 ; концентрация 61-68 %) может быть применена как добавка (30-50 г/л HN03) к соляной кислоте при: подготовке в потоке к металлопокрытиям проволоки, имеющей очень загрязненную поверхность.
В этом случае удается быстро очистить поверхность металла, но при излишнем пребывании проволоки в таком, растворе наблюдается быстрое потемнение поверхности и разъедание ее с образованием темных пятен. Смесь азотной и соляной кислот очень агрессивно воздействует на металлические части оборудования.
Скорость снятия с поверхности проволоки окалины и ржавчины в растворах кислот можно значительно увеличить электрохимическим (электролитическим) травлением. Этот способ по сравнению с химическим травлением сокращает расход кислоты и потери металла, уменьшает водородную хрупкость. Различают анодный, катодный и катодно-анодный процессы электролитического травления.
Анодное травление, при котором проволока контактирует с положительным полюсом источника тока, основано на электрохимическом растворении металла и механическом отрывании оксидов выделяющимся кислородом. При этом на катоде происходит бурное выделение водорода. В качестве электролита применяют большей частью крепкий раствор серной кислоты (до 200-250 г/л) и иногда раствор хорошо электропроводящей соли соответствующего металла. Плотности тока при анодном травлении в серной кислоте обычно высокие: 50-200 А/дм 2 и выше. Применяемое напряжение 3-12 В.
Катодное травление происходит в результате восстановления и механического отрывания оксидов металла выделяющимся водородом. Электролитом при катодном методе могут быть те же растворы, что при анодном. Хорошие результаты травления обеспечивают растворы, состоящие из смеси серной и соляной кислот.
Катодно-анодный процесс заключается в том, чтосначала обрабатываемый металл будет катодом в ванне с раствором серной кислоты (100-200 г/л), а затем уже в ванне с более плотным раствором (500-700 г/л) он становится анодом. При этом в первой ванне окалина интенсивно удаляется в результате восстановления водородом, аво второй поверхность металла очищается от темного налета и становится светлой и блестящей.
В практике сталепроволочного производства из электрохимических способов травления наиболее распространенным является анодный.
После анодного травления в растворах солей железа, а также в разбавленных кислотах на поверхности проволоки остается шлам, состоящий из FeзС и карбида FезС, плохо растворяющихся в серной кислоте. Образования шлама можно не допустить, если травление вести в концентрированном электролите из серной кислоты. Для удаления образовавшегося шлама следует проводить электрохимическую обработку в растворах щелочей или химическую обработку в специальных растворах.
Декапирование – это процесс удаления тонкой; пленки оксидов и других загрязнений, образующихся на уже подготовленной к покрытию поверхности металла (век время транспортировки, недлительного хранения, при травлении и других случаях). Кроме того, по своему характеру декапирование представляет процесс активации поверхности металла, так как, кроме удаления оксидов, шлама и других загрязнений, происходит выявление его кристаллической структуры, что способствует лучшему сцеплению основного металла с покрытием.
Следует заметить, что в сталепроволочном производстве понятия «декапирование» и «травление» бывает трудно четко разделить, так как не всегда используются они оба и во многих случаях при подготовке проволоки к волочению и металлопокрытию установленные процессы выполняв ют задачи и травления, и декапирования одновременно.
При травлении высоколегированных сталей) для ускорения и уменьшения потерь металла иногда используют два или три травильных раствора, в которых поочередно обрабатывают металл. Последний из этих растворов служит для отбеливания (осветления) поверхности.
Дата добавления: 2015-12-16 ; просмотров: 4916 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Технология производства металлопроката | Опыт. Исследования. Результаты.

Немного об окалине
 В силу ряда особенностей горячей прокатки и последующего охлаждения горячекатаных полос их поверхность покрыта окалиной неодинаковой толщины и различного фазового состава. В результате взаимодействия железа с кислородом среды, в которой оно находится при сравнительно высоких температурах, образуются три устойчивых окисла: вюстит (FeO), магнетит (Fe3O4) и гематит (Fe2O3). Слои, составляющие окалину, располагаются таким образом, что непосредственно к металлу примыкает слой окисла с наименьшим содержанием кислорода FeO, далее следует средний слой промежуточного состава Fe3O4, наружный слой окалины состоит из высшего окисла Fe2O3. Соотношение толщин слоев и одновременное существование всех трех окислов зависят от условий окисления поверхности железа.
В силу ряда особенностей горячей прокатки и последующего охлаждения горячекатаных полос их поверхность покрыта окалиной неодинаковой толщины и различного фазового состава. В результате взаимодействия железа с кислородом среды, в которой оно находится при сравнительно высоких температурах, образуются три устойчивых окисла: вюстит (FeO), магнетит (Fe3O4) и гематит (Fe2O3). Слои, составляющие окалину, располагаются таким образом, что непосредственно к металлу примыкает слой окисла с наименьшим содержанием кислорода FeO, далее следует средний слой промежуточного состава Fe3O4, наружный слой окалины состоит из высшего окисла Fe2O3. Соотношение толщин слоев и одновременное существование всех трех окислов зависят от условий окисления поверхности железа.
Важная характеристика окалины – ее сплошность (пористость). Трещины и поры возникают в слое окалины в период охлаждения металла в результате преобразований структуры. При образовании окалины, состоящей из вюстита, приращение объема составляет 1,76 , а из магнетита и гематита соответственно 2,1 и 2,4. Чем выше температура окисления, тем больше образуется различных окислов, обладающих разной пластичностью. Превращение их приводит к возникновению внутренних напряжений, вызывающих образование трещин и пор. При травлении в соляной кислоте быстрее всего растворяется закись железа (вюстит), образующий наиболее пористый слой. Однако вюстит обычно содержится только в слое окалины, прилегающем к металлу. Наружный слой состоит из магнетита и гематита, которые растворяются незначительно. Наличие пор и трещин в окалине ускоряет травление. Раствор кислоты проникает через эти несплошности к поверхности металла и слою вюстита. Наряду с растворением вюстита происходит взаимодействие ионов водорода кислоты с металлическим железом. По мере растворения слоя вюстита уменьшается прочность сцепления окалины с основным металлом. Выделяющийся водород восстанавливает высшие окислы железа до закиси. Процесс растворения окалины, не содержащей вюстита, протекает медленнее и связан с повышенными потерями металла.
Опыт работы травильных линий показывает, что продолжительность травления окалины в значительной степени связана с температурой смотки, которая влияет на толщину и структуру окалины. Обычно сокращение продолжительности травления с уменьшением температуры смотки связывают со снижением степени превращения вюстита (FeO) в магнетит (Fe3O4), а также с уменьшением опасности появления гематита (Fe2O3) по кромкам полосы. При этом предполагается, что удаление окалины происходит путем растворения вюститной фазы вдоль границы раздела сталь-окалина и подвода кислоты к границе металла. При взаимодействии кислоты с железом образуется водород, который способствует отслоению окалины. При высокой температуре смотки на границе раздела фаз окалина-сталь вюстит отсутствует, т.е. основным механизмом удаления окалины является на отслоение гематита и магнетита, а их растворение.
С целью выяснения механизма влияния температуры смотки на продолжительность травления изучали фазовый состав окалины. Образцы железной окалины были отобраны от головной, средней и хвостовой частей полос, температура смотки которых составляла 580-600, 640-680 и 700-730 0 С. Изучение окалины проводили комплексными методами. На начальных этапах использовали химические методы селективного изолирования фаз. Общий состав оксидных фаз изолировали методом галогенирования в атмосфере сухого газообразного хлора при температуре 350 0 С. После удаления хлора путем вымораживания смесь оксидов и хлоридов нагревали до температуры возгонки. После возгонки FeCl2 оксидные фазы переводили в раствор путем сплавления с персульфатом калия и количественный анализ по составляющим элементам вели химическим и атомно-абсорбционными методами на спектрофотометре.
Таблица 1 – Фазовый состав железной окалины при различной температуре смотки полос