- Атомная масса и плотность простых веществ
- Uzdevumi.lv
- Žurnāls
- Moodle
- Поиск
- Видео-урок
- Урок посвящен решению задач из ЕГЭ по теме «Строение вещества (типы химической связи, типы кристаллических решеток, степени окисления)». Цели урока: научиться сопоставлять типы кристаллических решеток со свойствами вещества. По типу химической связи прогнозировать типы кристаллической решетки вещества. Проверить понимание понятий: степень окисления и валентность.
 В таблице приводятся основные физические свойства простых веществ: плотность при температуре 20°С (в случае, если плотность измерена при другой температуре, последняя указана в скобках), температура плавления и температура кипения веществ в градусах Цельсия.
В таблице приводятся основные физические свойства простых веществ: плотность при температуре 20°С (в случае, если плотность измерена при другой температуре, последняя указана в скобках), температура плавления и температура кипения веществ в градусах Цельсия.
Указаны плотность и температуры плавления и кипения следующих простых веществ: азот N2, актиний Ac, алюминий Al, америций Am, аргон Ar, астат At, барий Ba, бериллий Be, бор B, бром Br, ванадий V, висмут Bi, водород H2, вольфрам W, гадолиний Gd, галлий Ga, гафний Hf, гелий He, германий Ge, гольмий Ho, диспрозий Dy, европий Eu, железо Fe, золото Au, индий In, йод (иод) J, иридий Ir, иттербий Yb, иттрий Y, кадмий Cd, калий K, кальций Ca, кислород O2, озон O3, кобальт Co, кремний Si, криптон Kr, ксенон Xe, кюрий Cm, лантан La, литий Li, лютеций Lu, магний Mg, марганец Mn, медь Cu, молибден Mo, мышьяк As, натрий Na, неодим Nd, неон Ne, нептуний Np, никель Ni, ниобий Nb, олово Sn, осмий Os, палладий Pd, платина Pt, плутоний Pu, полоний Po, празеодим Pr, прометий Pm, протактиний Pa, радий Ra, радон Rn, рений Re, родий Rh, ртуть Hg, рубидий Rb, рутений Ru, самарий Sm, свинец Pb, селен Se, сера S, серебро Ag, скандий Sc, стронций Sr, сурьма Sb, таллий Tl, тантал Ta, теллур Te, тербий Tb, технеций Tc, титан Ti, торий Th, тулий Tu, углерод C (алмаз, графит), уран U, фосфор P (белый, красный), франций Fr, фтор F, хлор Cl, хром Cr, цезий Cs, церий Ce, цинк Zn, цирконий Zr, эрбий Er.
Следует отметить, что плотность веществ в таблице выражена в размерности кг/м 3 . В таблице можно выделить вещества (химические элементы) с минимальной и максимальной плотностью. Наименьшей плотностью из химических элементов обладают газы — например, плотность водорода равна всего 0,08987 кг/м 3 — это самый легкий газ на планете. Из тяжелых элементов высокой плотностью отличаются вольфрам, уран, нептуний, осмий и другие металлы.
Цифры в скобках означают, что вещество при данной температуре разлагается. Сокращения: г. — газ, ж. — жидкость, тв. — твердое вещество, возг. — возгоняется, ромб. — ромбическая структура.
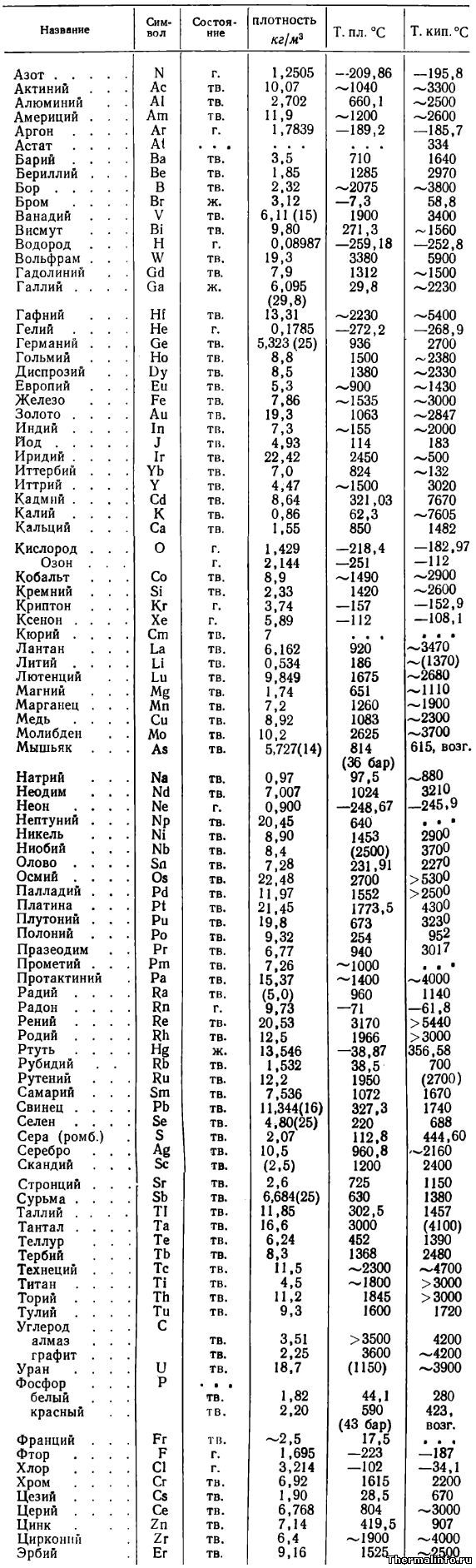
По данным таблицы можно выделить вещества, обладающие минимальной и максимальной температурой плавления и кипения. Самую низкую температуру плавления имеет химический элемент гелий — его температура плавления равна минус 272,2 °С. Гелий также обладает и самой низкой температурой кипения.
Самую высокую температуру плавления среди простых веществ имеет такой химический элемент, как углерод в виде графита. Он начинает плавиться при температуре 3600°С. Другая модификация углерода — алмаз также относится к тугоплавким веществам с температурой плавления 3500°С.
Самую высокую температуру кипения имеет элемент кадмий, он кипит при температуре не ниже 7670°С, хотя начинает плавиться всего лишь при 321°С.
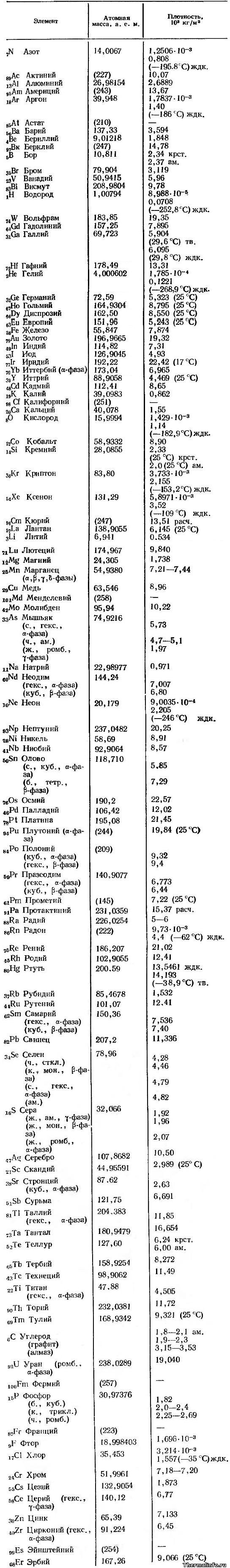
Атомная масса и плотность простых веществ
В таблице приведена атомная масса и плотность следующих химических элементов: азот ,актиний, алюминий, америций, аргон, астат, барий, бериллий, берклий, бор, бром, ванадий, висмут, водород, вольфрам, гадолиний, галлий, гафний, гелий, германий, гольмий, диспрозий, европий, железо, золото, индий, йод, иридий, иттербий, иттрий, кадмий, калий, калифорний, кальций, кислород, кобальт, кремний, криптон, ксенон, кюрий, лантан, литий, лютеций, магний, марганец, медь, менделевий, молибден, мышьяк, натрий, неодим, неон, нептуний, никель, ниобий, олово, осмий, палладий, платина, плутоний, полоний, празеодим, прометий, протактиний, радий, радон, рений, родий, ртуть, рубидий, рутений, самарий, свинец, селен, сера, серебро, скандий, стронций, сурьма, таллий, тантал, теллур, тербий, технеций, титан, торий, тулий, углерод (графит, алмаз), уран, фермий, фосфор, франций, фтор, хлор, хром, цезий, церий, цинк, цирконий, эйнштейний, эрбий.
Указанные значения плотности соответствуют плотности веществ при температуре 20°С и атмосферном давлении, за исключением тех случаев, когда в скобках указана другая температура.
Плотность элементов дана в размерности тонна на кубометр. Например, плотность жидкого азота при температуре -195,8°С равна 0,808 т/м 3 или 808 кг/м 3 ; плотность хлора в газообразном состоянии равна 3,214 кг/м 3 , жидкого — 1557 кг/м 3 . Значения плотности веществ приведены для их естественного молекулярного и агрегатного состояний при указанной температуре.
 Источники:
Источники:
1. Писаренко В.В. Справочник лаборанта-химика. Справ. пособие для проф.-техн. учебн. заведений. М., «Высшая школа», 1970. — 192 стр. с илл.
2. Физические величины. Справочник. А.П. Бабичев, Н.А. Бабушкина, А.М. Братковский и др.; Под ред. И.С. Григорьева, Е.З. Мейлихова. — М.: Энергоатомиздат, 1991. — 1232 с.
Uzdevumi.lv

Žurnāls

Moodle

Поиск

Видео-урок
Урок посвящен решению задач из ЕГЭ по теме «Строение вещества (типы химической связи, типы кристаллических решеток, степени окисления)». Цели урока: научиться сопоставлять типы кристаллических решеток со свойствами вещества. По типу химической связи прогнозировать типы кристаллической решетки вещества. Проверить понимание понятий: степень окисления и валентность.
Вопрос
Комментарий
А1. Сложными веществами называют:
1. соединения, образованные разными веществами
2. соединения, образованные разными химическими элементами
3. соединения, имеющие постоянный состав
4. соединения, имеющие переменный состав
Простое вещество – это соединение, образованное атомами одного химического элемента, а сложное вещество образовано атомами различных химических элементов.
Правильный ответ 2.
А2. Наибольшую температуру плавления имеет вещество формула которого:
Нужно знать, какие кристаллические решетки имеют данные вещества: СН4 – молекулярную, SiO2 – атомную, Sn – металлическую, КF –ионную.Наиболее высокой температурой плавления характеризуются вещества с атомной кристаллической решеткой.
Правильный ответ 2.
А3. Веществами молекулярного строения являются все вещества ряда:
1. сера, поваренная соль, сахар
2. сахар, поваренная соль, глицин
3. сахар, глицин, медный купорос
4. сера, глицерин, сахар
Сера, сахар, глицин, глицерин – вещества молекулярного строения. Поваренная соль и медный купорос имеют ионную кристаллическую решетку. Это вещества немолекулярного строения.
Правильный ответ 4.
А4. К веществам молекулярного строения относится:
Анализируем: к какому типу кристаллических решеток относятся данные вещества. СаО, КF, С2Н5ОNa имеют ионную кристаллическую решетку. С6Н12О6 – молекулярную.
Правильный ответ 2.
А5. Из перечисленных веществ немолекулярное строение имеет:
Если в веществе содержится несколько атомов (I2), то это вещество молекулярного строения.
Правильный ответ 3.
А6.Химическая связь в бромиде калия:
1. ковалентная неполярная
2. ковалентная полярная
Бромид калия (КBr) – это типичная соль, образованная атомами, резко отличающимися по электроотрицательности. Связь ионная.
Правильный ответ 4.
А7. Какая связь возникает между атомами химических эелентов с порядковыми номерами 8 и 16?
2. ковалентная полярная
3. ковалентная неполярная
Это S и О. Это неметаллы. Их электроотрицательности близки. Значит, связь ковалентная полярная.
Правильный ответ 2.
А8. Связь в соединении, образованном между атомом водорода и элементом, имеющим электронную конфигурацию 2,8,6 является:
2. ковалентная полярная
3. ковалентная неполярная
Находим элемент по распределению электронов в атоме. Их сумма равна количеству протонов, порядковому номеру. Это № 1 – S. Они между собой образуют H2S. Оба неметаллы, с небольшой разницей в электроотрицательности.
Правильный ответ 2.
А9. В ковалентных водородных соединениях состава НЭ число общих электронных пар равно:
Атом водорода имеет только один электрон, поэтому при взаимодействии с другими атомами он может образовывать только одну общую электронную пару.
Правильный ответ 1.
А10. Одна из связей в ионе аммония образована:
1. по донорно-акцепторному механизму
2. электростатическим притяжением ионов азота и водорода
3. обобществлением ионов азота и водорода
4. вследствие обмена электронами
В ионе аммония есть 4 ковалентные связи. Три из них образованы по обменному механизму, одна – по донорно-акцепторному.
Правильный ответ 1.
А11. Степень окисления фосфора в соединении H3PO4 равна:
Сумма степеней окисления с учетом количества атомов, должна быть равна 0. Н + , О -2 , поэтому Р +5 .
Правильный ответ 4.
А 12. Постоянную степень окисления имеет атом элемента:
Так как элементы I-A группы имеют один валентный электрон, то они могут проявлять лишь одну степень окисления +1.
Правильный ответ 4.
А13. Кристаллическая решетка графита:
Графит образован углеродом – неметаллом. Значит, кристаллическая решетка не может быть ионной, металлической или молекулярной.
Правильный ответ 1.
А14. В узлах кристаллических решеток веществ молекулярного строения находятся:
4. Молекулы и ионы
В узлах кристаллических решеток веществ молекулярного строения находятся молекулы.
Правильный ответ 1.
А15.Из приведенных ниже веществ атомную кристалличекую решетку имеет:
Магний – это металл. Он имеет металлическую кристаллическую решетку. Сера, нафталин – молекулярную кристаллическую решетку.
Правильный ответ 4.
А16. Для веществ с металлической кристаллической решеткой нехарактерным свойством является:
Для металлов характерны такие свойства: электро- и теплопроводность, пластичность, металлический блеск. Хрупкость – это свойство, обратное пластичности, значит, металлы им обладать не могут.
Правильный ответ 3.


На уроке рассматривалось решение задач из ЕГЭ по теме «Строение вещества (типы химической связи, типы кристаллических решеток, степени окисления)». Мы учились сопоставлять типы кристаллических решеток со свойствами вещества. По типу химической связи прогнозировать типы кристаллической решетки вещества. Проверялось понимание понятий: степень окисления и валентность.
Список литературы
- Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
- Попель П.П. Химия: 11 кл.: учебник для общеобразовательных учебных заведений / П.П. Попель, Л.С. Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
- Учебно-тренировочные материалы для подготовки к единому государственному экзамену. Химия/Каверина А.А., Добротин Д.Ю., Медведев Ю.Н.,Корощенко А.С. – М.: Интеллект-Центр, 2011.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
Домашнее задание
- №№ 11–33 (с. 23) Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень/ Г. Е. Рудзитис, Ф.Г. Фельдман. – 14-е издание. – М.: Просвещение, 2012.
- При полном окислении 2 г простого вещества образуется 18 г оксида составаЭ2О. Найти молярную массу простого вещества.
- Определите валентность и степень окисления углерода в соединениях: С2Н5ОН, СН3СООН.





1. Строение атома
2. Периодич. закон
3. Химическая связь
4. Степ. окисл. Валентн.
5. Строение вещества
6. Классиф. веществ
7. Простые вещества
9. Гидрокс. Кислоты
11. Неорганич. в-ва
12. Строение орг. в-в
14. Спирты. Фенолы
15. Альдег. Кислоты
16. Получ. орг.вещ.
17. Азотсодерж. соед.
18. Взаимосв. орг. .в-в
19. Классиф. реакций
20. Скорость реакции
21. Электр. дисс. РИО
22. Хим. лаборатория
23. Хим. производст.
25. Термохим. расчеты
26. Расч. по уравнен.
30. Гидролиз солей
31. Хим. равновесие
32. Неорг. вещества
33. Качествен. реакции
36. Электр. баланс
37. Неорг. вещества
38. Органич. цепочки
39. Раствор и реакции
40. Вывод формулы
Виртуальная химическая школа
Тестовый практикум по ЕГЭ
Вещества молекулярного и немолекулярного строения. Типы кристаллических решёток. Зависимость свойств веществ от их состава и строения.
1. Молекулярное строение имеет
1) С1 2 2) СаО 3) ZnCl 2 4) NaBr
2. Кристаллическая решетка хлорида кальция
3. Кристаллическая решетка твердого оксида углерода ( IV)
4. Молекулярную кристаллическую решетку имеет
5. Немолекулярное строение имеет
6. Молекулярное строение имеет
4) поваренная соль
7. Немолекулярное строение имеет
1) азот 2) графит 3) аммиак 4) кислород
8. Наибольшую температуру плавления имеет
3) оксид углерода (IV)
4) оксид кремния (IV)
9. Ионное строение имеет
2) оксид углерода (IV)
3) оксид серы (VI)
10. Вещества с металлической кристаллической решеткой
1) хрупкие, легкоплавкие
2) проводят электрический ток, пластичные
3) обладают низкой тепло- и электропроводностью
4) обладают хорошими оптическими свойствами
11. Немолекулярное строение имеет каждое из двух веществ:
1) СО 2 иС l 2 2) Fe и NaCl 3) СО и Mg 4) Na 2 CO 3 и I 2 (тв)
12. Вещества твердые, прочные, с высокой температурой плавления, расплавы которых проводят электрический ток, имеют кристаллическую решетку
13. Молекулярную кристаллическую решетку имеет
2) оксид углерода (IV)
3) оксид кремния
4) нитрат аммония
14. Молекулярная кристаллическая решетка характерна для каждого из веществ, расположенных в ряду:
1) хлорид калия, азот, метан
2) иод, диоксид углерода, гелий
3) алюминий, бром, алмаз
4) водород, сульфат магния, оксид железа (Ш)
15. Ионную кристаллическую решетку имеет каждое из веществ, расположенных в ряду:
1) натрий, хлорид натрия, гидрид натрия
2) кальций, оксид кальция, карбонат кальция
3) бромид натрия, сульфат калия, хлорид железа (II)
4) фосфат магния, хлорид калия, оксид фосфора (V)
16. Молекулярное строение имеет
17. Ионы являются структурными частицами
3) оксида углерода (IV)
4) хлорида натрия
18. Металлическую кристаллическую решетку имеет
19. Кристаллическая решетка брома
20. Верны ли следующие суждения о зависимости свойств веществ от особенностей их кристаллической решетки?
А. Расплавы веществ с ионной кристаллической решеткой проводят электрический ток.
Б. Алмаз и кварц имеют атомную кристаллическую решетку.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
21. Немолекулярное строение имеет
22. Ионы являются структурной единицей для каждого из двух веществ:
1) СН 4 и I 2 2) SO, и Н 2 О 3) С l 2 и NH 3 4) LiF и KCl
23. Молекулярное строение имеет каждое из двух веществ:
24. Молекулярную кристаллическую решетку имеет
1) фторид кальция
2) бромид алюминия
4) хлорид меди (П)
25. Молекулярное строение имеет
26. Вещества только немолекулярного строения приведены в ряду
2) Fe, NaCl ( тв), алмаз
27. Утверждение о том, что структурной частицей данного вещества является молекула, справедливо только для