- Содержание
- Получение [ править | править код ]
- В лаборатории [ править | править код ]
- В промышленности [ править | править код ]
- Получение пиролизом [ править | править код ]
- Карбидный метод [ править | править код ]
- Физические свойства [ править | править код ]
- Химические свойства [ править | править код ]
- История [ править | править код ]
- Применение [ править | править код ]
- Безопасность [ править | править код ]
Этилен. 1) Дегидратация этилового спирта с помощью серной кислоты была уже давно отвергнута промышленностью и заменена каталитической дегидратацией. В качестве катализатора дегидратации этилового спирта обычно применяется окись алюминия, рабочая температура реакции находится в пределах 250—400°. Процесс проводится в реакторе, снабженном рубашкой для обогрева. Обогрев производится парами ртути. Газ, выходящий из реактора, охлаждается, компримируется, сушится и подвергается низкотемпературной ректификации. В результате получается весьма чистый этилен. При дегидратации спирта в производстве бутадиена по Лебедеву этилен получается в качестве побочного продукта с выходом около 5—8%. Этот этилен, так же как и этилен, полученный предыдущим способом, вполне пригоден для полимеризации, поскольку он не содержит прерывающих ее примесей. Необходимо только этилен, получающийся в производстве бутадиена по способу Лебедева, очистить вымораживанием от содержащегося в нем ацетальдегида, поскольку последний препятствует полимеризации.
2) Из ацетилена этилен получается путем частичного гидрирования при атмосферном или слегка повышенном давлении. Исходный ацетилен не должен содержать примеси, отравляющие катализатор. Перед переработкой ацетилен подвергается очистке на промывных установках, орошаемых хлорной водой, затем промывается разбавленным раствором щелочи и сушится. Водород также не должен содержать контактных ядов. Реакторы гидрирования, соединенные в батареи, имеют внутри решетки, на которых размещается катализатор, палладий на двуокиси кремния. Сначала смесь ацетилена и водорода нагревают до 200°; в процессе гидрирования температура в реакторах поддерживается в пределах 180— 230° за счет тепла реакции и регулируется орошением катализатора водой. С постепенным старением катализатора реактор по мере надобности нагревают дымовыми газами. Выходящий из реактора газ имеет следующий состав: 80 объем. % паров и 20 объем. % газа, содержащего 50—60% этилена, 3% этана, 3% азота, 0,8% ацетилена и около 30% водорода. После охлаждения и отделения воды сырой этилен сжижают в разделителе Линде и подвергают низкотемпературной фракционированной дистилляции. Очищенный продукт содержит 94—96% этилена, 3—4% этана, приблизительно 1% азота и около 0,5% ацетилена. Этилен, получаемый из ацетилена, для полимеризации не годится. Он применяется для производства стирола.
3) При производстве этилена из этан-пропановой фракции смесь обоих углеводородов, к которой прибавляют небольшое количество водяного пара, подвергают кратковременному действию температуры 750—800°. Реакционную смесь быстро охлаждают, газы компримируют, отделяют от воды и подвергают низкотемпературной ректификации. На аналогичном принципе основано производство этилена путем высокотемпературного дегидрирования этана (температура около 900°). Этот процесс проводится при давлении 0,5 атм; этан подается на дегидрирование в смеси с азотом. Процесс проводится в реакторе из специальной хромистой стали (20—30% хрома) с содержанием никеля менее 0,2%, так как последний способствует побочным реакциям и образованию углерода. Примесь кремния оказывает противоположное действие. Газ, выходящий из реактора, содержит около 33% этилена, небольшое количество ароматических углеводородов и около 0,3% ацетилена, который получается в результате дальнейшего дегидрирования этилена. Путем охлаждения ацетилен освобождают от примесей смолистых веществ и подвергают гидрированию при температуре 180—230°, превращая его практически количественно в этилен. Катализатором этого процесса служит металлический никель (5%) на окиси хрома (95%). Сырой этилен пропускают через абсорберы, заполненные активированным углем, в которых задерживаются ароматические углеводороды. Окончательная очистка этилена заключается в абсорбции его раствором хлорида меди (I) при 15 атм. Содержащиеся в газе олефины отделяются постепенным снижением давления до 3—1,4; 1—0,35; 0,1 атм. Газы, отделенные в результате первого и второго снижения давления, содержат гомологи этилена, и их возвращают на абсорбцию. Этим способом получается не менее 96% этилена с выходом не менее 79—80% от теоретического, считая на этан.
4) Другим способом производства этилена является частичное окисление этана воздухом или кислородом при температуре 800—850°. Оба газа прежде всего нагревают: этан до 650°, кислород до 550°, а затем смешивают в отношении 3:1 в небольшой камере смешения, откуда с большой скоростью подают в основной аппарат — камеру сжигания. Камера сжигания заполнена кольцами Рашига, чтобы смешение газов было наилучшим. Благодаря короткому времени контактирования снижается образование углерода и формальдегида. Отходящий из камеры сжигания газ, который содержит примерно 33 объем. % этилена, 26,3% водорода, 14,1% этана, 11,5% окиси углерода, 7,6% метана, 4,2% азота, 1,1% пропана, 0,7% углекислого газа и 0,6% кислорода, охлаждают водой, сушат и после сжижения подвергают с целью очистки низкотемпературной дистилляции на разделителе Линде. Регенерированный этан вновь возвращают на переработку. Выход этилена по этому методу составляет 80% от теоретического.
Ацетилен. В промышленности ацетилен часто получают действием воды на карбид кальция. Сейчас широко применяются методы получения ацетилена из природного газа – метана: электрокрекинг (струю метана пропускают между электродами при температуре 1600°С и быстро охлаждают, чтобы предотвратить разложение ацетилена); термоокислительный крекинг (неполное окисление), где в реакции используют теплоту частичного сгорания ацетилена.
В промышленности ацетилен получают из карбида кальция и пиролизом углеводородного сырья — метана или пропана с бутаном. В последнем случае ацетилен получают совместно с этиленом. Карбидный метод позволяет получать чистый ацетилен, но требует высокого расхода электроэнергии. Пиролиз менее энергозатратен, но образующийся ацетилен имеет низкую концентрацию в газовом потоке и требует выделения. Экономические оценки обоих методов многочисленны, но противоречивы.
| Ацетилен | |
|---|---|
 | |
  | |
| Общие | |
| Систематическое наименование | Этин |
| Традиционные названия | Ацетилен |
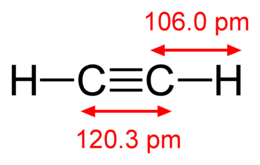
| Хим. формула | C2H2 |
| Рац. формула | HCCH |
| Физические свойства | |
| Молярная масса | 26,038 [1] г/моль |
| Плотность | 1,0896 г/л |
| Энергия ионизации | 11,4 ± 0,1 эВ [2] |
| Термические свойства | |
| Т. плав. | -80,8 1277 мм Hg °C |
| Т. субл. | −119 ± 1 °F [2] |
| Т. кип. | −83,6 °C |
| Т. свспл. | 335 °C |
| Пр. взрв. | 2,5 ± 0,1 об.% [2] |
| Тройная точка | −80,55 |
| Кр. точка | 35,2°С; 6,4 МПа |
| Мол. теплоёмк. | 44,036 Дж/(моль·К) |
| Энтальпия образования | +226,88 кДж/моль |
| Энтальпия сгорания | –1302 кДж/моль |
| Давление пара | 44,2 ± 0,1 атм [2] |
| Химические свойства | |
| pKa | 25 |
| Растворимость в воде | 100 18 мл/100 мл |
| Растворимость в этаноле | 600 18 мл/100 мл |
| Структура | |
| Гибридизация | sp |
| Классификация | |
| Рег. номер CAS | 74-86-2 |
| PubChem | 6326 |
| Рег. номер EINECS | 200-816-9 |
| SMILES | |
| RTECS | AO9600000 |
| ChEBI | 27518 |
| Номер ООН | 1001 |
| ChemSpider | 6086 |
| Безопасность | |
| Токсичность |
|
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Содержание
Получение [ править | править код ]
В лаборатории [ править | править код ]
В лаборатории, а также в газосварочном оборудовании, ацетилен получают действием воды на карбид кальция [3] (Ф. Вёлер, 1862 год) [4] :
C a C 2 + 2 H 2 O → C a ( O H ) 2 + C 2 H 2 ↑ <displaystyle <mathsf <2>+2H_<2>O
ightarrow Ca(OH)_<2>+C_<2>H_<2>uparrow >>>
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
2 C H 4 → C 2 H 2 + 3 H 2 <displaystyle <mathsf <2CH_<4>
ightarrow C_<2>H_<2>+3H_<2>>>>
В промышленности [ править | править код ]
В промышленности ацетилен получают гидролизом карбида кальция и пиролизом углеводородного сырья — метана или пропана с бутаном. В последнем случае ацетилен получают совместно с этиленом и примесями других углеводородов. Карбидный метод позволяет получать очень чистый ацетилен, но требует высокого расхода электроэнергии. Пиролиз существенно менее энергозатратен, т.к. для нагрева реактора используется сгорание того же рабочего газа во внешнем контуре, но в газовом потоке продуктов концентрация самого ацетилена низка. Выделение и концентрирование индивидуального ацетилена в таком случае представляет сложную задачу. Экономические оценки обоих методов многочисленны, но противоречивы [5] [:стр. 274] .
Получение пиролизом [ править | править код ]
Электрокрекинг [ править | править код ]
Метан превращают в ацетилен и водород в электродуговых печах (температура 2000—3000 °С, напряжение между электродами 1000 В). Метан при этом разогревается до 1600 °С. Расход электроэнергии составляет около 13000 кВт•ч на 1 тонну ацетилена, что относительно много (примерно равно затрачиваемой энергии по карбидному методу) и потому является недостатком процесса. Выход ацетилена составляет 50 %.
Регенеративный пиролиз [ править | править код ]
Иное название — Вульф-процесс. Сначала разогревают насадку печи путём сжигания метана при 1350—1400 °С. Далее через разогретую насадку пропускают метан. Время пребывания метана в зоне реакции очень мало и составляет доли секунды. Процесс реализован в промышленности, но экономически оказался не таким перспективным, как считалось на стадии проектирования.
Окислительный пиролиз [ править | править код ]
Метан смешивают с кислородом. Часть сырья сжигают, а образующееся тепло расходуют на нагрев остатка сырья до 1600 °С. Выход ацетилена составляет 30—32 %. Метод имеет преимущества — непрерывный характер процесса и низкие энергозатраты. Кроме того, с ацетиленом образуется еще и синтез-газ. Этот процесс (Заксе-процесс или BASF-процесс) получил наиболее широкое внедрение.
Гомогенный пиролиз [ править | править код ]
Является разновидностью окислительного пиролиза. Часть сырья сжигают с кислородом в топке печи, газ нагревается до 2000 °С. Затем в среднюю часть печи вводят остаток сырья, предварительно нагретый до 600 °С. Образуется ацетилен. Метод характеризуется большей безопасностью и надёжностью работы печи.
Пиролиз в струе низкотемпературной плазмы [ править | править код ]
Процесс разрабатывается с 1970-х годов, но, несмотря на перспективность, пока не внедрён в промышленности. Сущность процесса состоит в нагреве метана ионизированным газом. Преимущество метода заключается в относительно низких энергозатратах (5000—7000 кВт•ч) и высоких выходах ацетилена (87 % в аргоновой плазме и 73 % в водородной).
Карбидный метод [ править | править код ]
Этот способ известен с XIX века, но не потерял своего значения до настоящего времени. Сначала получают карбид кальция, сплавляя оксид кальция и кокс в электропечах при 2500—3000 °С:
C a O + 3 C → C a C 2 + C O ↑ <displaystyle <mathsf <2>+COuparrow >>>
C a C O 3 → C a O + C O 2 ↑ <displaystyle <mathsf <3>
ightarrow CaO+CO_<2>uparrow >>>
Далее карбид кальция обрабатывают водой:
C a C 2 + 2 H 2 O → C 2 H 2 + C a ( O H ) 2 <displaystyle <mathsf <2>+2H_<2>O
ightarrow C_<2>H_<2>+Ca(OH)_<2>>>>
Получаемый ацетилен имеет высокую степень чистоты 99,9 %. Основным недостатком процесса является высокий расход электроэнергии: 10000—11000 кВт•ч на 1 тонну ацетилена.
Физические свойства [ править | править код ]

При нормальных условиях — бесцветный газ, легче воздуха. Чистый 100 % ацетилен не обладает запахом. Технический ацетилен хранится в баллонах с пористым наполнителем, пропитанным ацетоном (т.к. чистый ацетилен при сжатии взрывается), и может содержать другие примеси, которые придают ему резкий запах [6] . Малорастворим в воде, хорошо растворяется в ацетоне. Температура кипения −83,6 °C [7] . Тройная точка −80,55 °C при давлении 961,5 мм рт. ст., критическая точка 35,18 °C при давлении 61,1 атм [8] .
Ацетилен требует большой осторожности при обращении. Может взрываться от удара, при нагреве до 500 °C или при сжатии выше 0,2 МПа [4] при комнатной температуре. Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки. Для хранения ацетилена используются специальные баллоны, заполненные пористым материалом, пропитанным ацетоном [9] .
Ацетилен обнаружен на Уране и Нептуне.
Химические свойства [ править | править код ]

- Для ацетилена (этина) характерны реакции присоединения:
ClCH=CHCl>>>"> HC ≡ CH + Cl 2 ⟶ ClCH = CHCl <displaystyle <ce ClCH=CHCl>>>
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³ (50,4 МДж/кг). При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в
500 °C. В присутствии катализаторов, например, трикарбонил(трифенилфосфин)никеля, температуру реакции циклизации можно снизить до 60—70 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так, ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
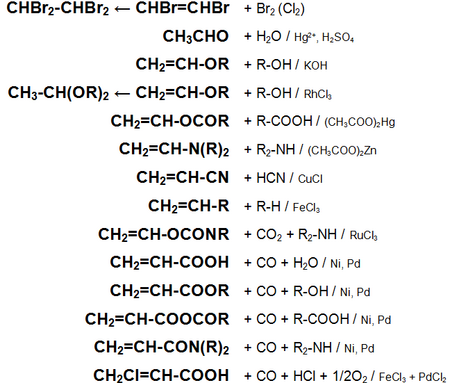
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
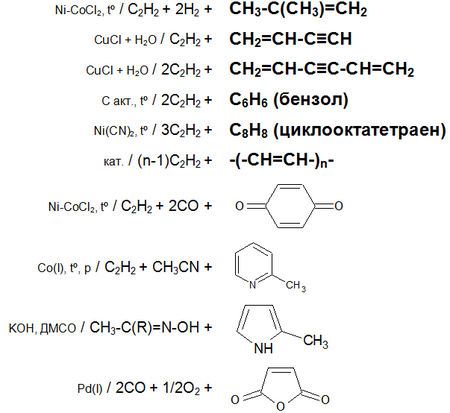
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Реагирует с аммиачными растворами солей Cu(I) и Ag(I) с образованием малорастворимых, взрывчатых ацетиленидов — эта реакция используется для качественного определения ацетилена и его отличия от алкенов (которые тоже обесцвечивают бромную воду и раствор перманганата калия).
История [ править | править код ]
Открыт в 1836 году Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 год).
Применение [ править | править код ]

- для газовой сварки и резкиметаллов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
- для получения технического углерода
- в атомно-абсорбционной спектрофотометрии при пламенной атомизации
- в ракетных двигателях (вместе с аммиаком) [10]
Безопасность [ править | править код ]
Поскольку ацетилен нерастворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3—80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном.
При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает незначительным токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м³ согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населённых мест».
ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), так как концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5—100 %.
Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углём) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5—2,5 МПа.
Ацетилен С2Н2 образуется при нагревании простейших углеводородов — метана, этана и этилена — до высоких температур, а также при сухой перегонке многих органических веществ. Он является постоянной составной частью светильного газа каменноугольного происхождения. Ацетилен был открыт в 1836 г. Дэви; подробному исследованию ацетилен и его соединения подверг Бертело (1860). Исторически очень большое значение имел произведенный Бертело синтез ацетилена из элементов, так как это был первый прямой синтез простейшего углеводорода. Бертело показал, что если создать электрическую дугу между угольными электродами в атмосфере водорода, то последний соединяется с углеродом. При температуре около 2500° С (как оказалось впоследствии, реакция начинается выше 1700° С) образуется 3,7% ацетилена, примерно 1,2% метана и следы этана. До недавнего времени основным источником получения ацетилена являлся производимый в громадных количествах ацетиленид кальция С2Са строения
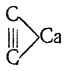
называемый обычно карбидом кальция. Действием на него воды получается ацетилен:
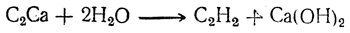
Эта реакция была открыта Вёлером еще в 1862 г., но практически она была использована лишь тридцать лет спустя.
Карбид кальция получается сплавлением негашеной извести с углем в электрической печи:
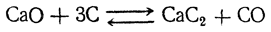
Карбид кальция в чистом виде — белое вещество, совершенно не обладающее взрывчатыми свойствами, которыми отличается большая часть металлических производных ацетилена.
В настоящее время ацетилен получается в промышленности также из парафиновых углеводородов (метана, этана, бутана) или легких нефтяных погонов. Основным условием образования ацетилена из метана является кратковременное, исчисляемое долями секунды пребывание исходного углеводорода в реакционной зоне при высокой температуре (1400—1600°С) и последующее резкое охлаждение газовой смеси. Необходимая для протекания реакции высокая температура может быть создана электрической дугой (в этом случае процесс называется электрокрекингом) или сжиганием части исходного или какого-либо другого углеводорода в кислородном или воздушном пламени (процесс, называемый термоокислительным пиролизом). Во всех случаях в результате реакции образуется сложная газовая смесь, содержащая наряду с ацетиленом непрореагировавшие исходные углеводороды, этилен, водород, высшие ацетиленовые углеводороды, сажу и другие соединения. Чистый ацетилен выделяется обычно из этой смеси в результате серии последовательных операций с помощью селективных растворителей.
Хотя суммарное уравнение этой реакции очень простое

однако механизм ее сложен и до сих пор неполностью выяснен. Несомненно, что она является радикальной цепной реакцией. Вероятнее всего эта цепь развивается так:
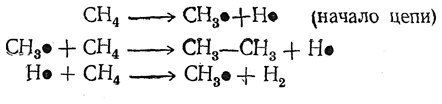
Этан превращается в этилен, а последний дает ацетилен. Не исключено и возникновение радикалов СН•, соединяющихся с образованием ацетилена.
Ацетилен образуется из элементов с большим поглощением тепла (—58 ккал/моль), поэтому при его сжигании выделяется громадное количество тепла (313 ккал/моль). Это является причиной чрезвычайной огнеопасности его смесей с воздухом; к тому же пределы взрываемости этих смесей весьма широки — от 3 до 82% ацетилена, тогда как смеси воздуха со светильным газом взрывают лишь при содержании от 5 до 28% светильного газа. Как соединение эндотермическое ацетилен является веществом взрывчатым, но при атмосферном давлении он не взрывает без детонатора. При повышенном же давлении, и особенно в жидком или твердом состоянии, он взрывает чрезвычайно легко. Сильно взрывчаты многие металлические производные ацетилена, особенно серебряные, ртутные и медные.
Ацетилен обладает наркотическими свойствами.
Смесь ацетилена с воздухом горит ярким пламенем. Когда ацетилен сгорает в смеси с вдуваемым в пламя кислородом, развивается температура, при которой легко могут быть расплавлены многие металлы. Этим пользуются для сварки метал. лов (автогенная сварка). При помощи узкого ацетилено-кислородного пламени можно разрезать стальные балки и другие массивные стальные предметы. В месте прикосновения пламени металл окисляется, а получающиеся окислы плавятся. Требуемый для автогенной сварки ацетилен получают из карбида на месте применения или доставляют в стальных баллонах, где он содержится растворенным в ацетоне под давлением 12—15 ат. Баллон заполняют пористой массой, адсорбирующей раствор ацетилена; в этих условиях ацетон растворяет около 300 объемов ацетилена. Попытки хранить в баллонах жидкий ацетилен были оставлены вследствие ряда происшедших взрывов.
Кислород окисляет ацетилен при 300° С с образованием формальдегида и окиси углерода; вероятно, промежуточно образуется кетен:


